PharmaMar (MSE: PHM) ha presentado resultados positivos del ensayo de registro de fase III, ADMYRE, de plitidepsina en combinación con dexametasona frente a dexametasona sola en pacientes con mieloma múltiple recurrente, en el marco de la 59º edición del congreso de la Sociedad Americana de Hematología (ASH, por sus siglas en inglés) que se celebra en Atlanta del 9 al 12 de diciembre. Estos datos se enviaron a la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) como parte del proceso de solicitud de comercialización de plitidepsina.
El poster titulado “Randomized Phase III Study (ADMYRE) of plitidepsin in combination with dexamethasone vs. dexamethasone alone in patients with relapsed/refractory multiple myeloma” recoge los datos obtenidos en este estudio de registro que incluyó a 255 pacientes, después de haber recibido previamente al menos tres regímenes terapéuticos, pero no más de seis, en 83 centros médicos de 19 países (incluidos Estados Unidos, Europa y Asia-Pacífico). Como ya se informó el 31 de marzo de 2016i , el estudio cumplió su objetivo primario.
En los pacientes que recibieron la combinación de plitidepsina con dexametasona (n=171) se observó una supervivencia libre de progresión (SLP) de 3,8 meses acorde con la evaluación del investigador, frente a 1,9 meses del brazo con dexametasona como agente único. Según el comité independiente de evaluación (IRC por sus siglas en inglés), la supervivencia libre de progresión fue de 2,6 meses para los pacientes que recibieron la combinación frente a 1,7 meses de los que recibieron solo dexametasona; cumpliendo así con el objetivo primario del estudio al demostrar una reducción del riesgo de progresión estadísticamente significativo sobre el comparador.
En cuanto a la supervivencia global (SG), se observó un incremento significativamente superior en el brazo de plitidepsina con dexametasona según el método estadístico empleado para corregir el efecto del crossover: el método de dos etapas de Latimer et al. En los pacientes que recibieron la combinación con plitidepsina, la supervivencia global registrada fue de 11,6 meses frente a los 6,4 meses del comparador, cuando se analizan los datos corrigiendo por el crossover.
Según el IRC, la tasa de respuesta objetiva (respuestas parciales o mejor respuesta) en los pacientes que recibieron plitidepsina fue del 13,8 %, con una mediana de duración de la respuesta de 12 meses. En los pacientes que respondieron al tratamiento de plitidepsina con dexametasona (12 %), la mediana de supervivencia global registrada fue de 37,8 meses y en los que se logró una estabilización de la enfermedad (65 %) fue de 17 de meses.
Datos de seguridad
En cuanto a los efectos adversos, la toxicidad hematológica registrada fue baja y en cuanto a las toxicidades más comunes: hepática y muscular, fueron transitorias y en la mayoría de los casos reversibles y manejables con ajuste de dosis.
Uno de los efectos adversos más comunes, de grado 3-4, asociados al tratamiento fue (pacientes que recibieron el tratamiento combinado frente a pacientes que recibieron dexametasona como agente único) mialgia (5 % / 0 %). En cuanto a los efectos secundarios relacionados con el tratamiento hematológicos y no hematológicos de grado 3 – 4, los más comunes fueron anemia (31 % / 35,4 %), trombocitopenia (22 % / 27,9 %), neutropenia (16 % / 5,1 %), aumento de los niveles de CPK (20 % / 0 %), de ALT (14 % / 0 %) y de AST (9 % / 0 %). La mayor parte de estos eventos fueron transitorios y reversibles. 15 pacientes (9 %) del brazo de plitidepsina con dexametasona abandonaron el tratamiento a causa de los efectos secundarios y 3 (6,5 %) entre los que recibieron dexametasona sola.
Durante la presentación de los resultados en ASH, se mostró una comparativa sobre las muertes asociadas al tratamiento de diferentes fármacos comercializados contra el mieloma múltiple: plitidepsina con dexametasona registró un 0,6%;pomalidomida con dexametasona, 4,6 %ii; panobinostat con bortezomib y dexametasona, 7,8 %iii; daratumumab, 0 %iv; bortezomib, 1,3 %v ; y lenalidomida con dexametasona, 2,8 %vi.
En el estudio ADMYRE se analizó la evolución del Performance Status, es decir, se calculó el tiempo que tardan los pacientes en empeorar su situación física y en que les afecte a su vida cotidiana desde el inicio del estudio. Los pacientes tratados en el brazo de plitidepsina en combinación con dexametasona tardaron el doble de tiempo en empeorar su performance status (PS) (4,6 meses) en comparación con dexametasona sola (2,3 meses).
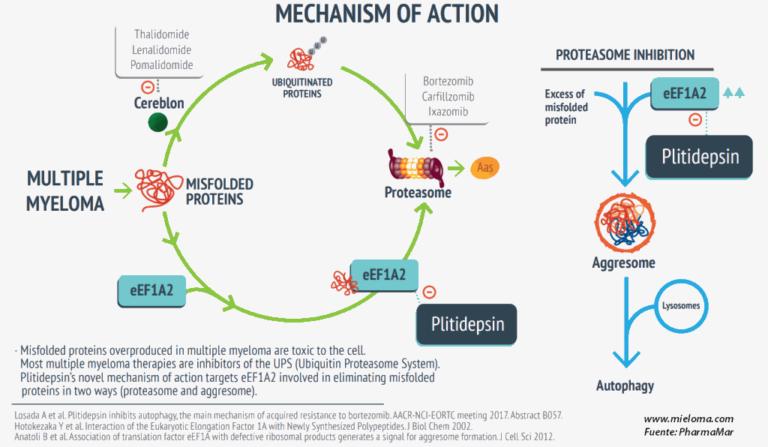
Mecanismo de acción de plitidepsina
El target de plitidepsina es la proteína eEF1A2. La unión de plitidepsina a esta proteína bloquea su propiedad pro oncogénica e impide el transporte de las proteínas mal secuenciadas –que son tóxicas para el tumor- al proteasoma para su destrucción. También se impide la activación del agresoma por parte de eEF1A2 y su destrucción en el lisosoma. Esto provoca un exceso de proteínas mal secuenciadas y la muerte celular por apoptosis. Otros tratamientos son complementarios a plitidepsina y bloquean el proteasoma o el cereblón que identifica las proteínas mal secuenciadas.
Además, en otro estudio in vitro que PharmaMar también ha presentado en el congreso de ASH, se concluye que plitidepsina reduce el número de osteoclastos maduros y su función a una concentración de plitidepsina hasta 100 veces menor que la que se considera necesaria para eliminar a las células de mieloma. Los osteoclastos son las células de mieloma múltiple destructoras del hueso.
Sobre plitidepsina
Plitidepsina se encuentra actualmente en desarrollo clínico para diferentes tumores hematológicos, incluyendo un ensayo fase Ib en mieloma múltiple en recaída o refractario con triple combinación de tratamiento con plitidepsina, bortezomib y dexametasona y un fase II en pacientes con mieloma múltiple refractarios a lenalidomida y bortezomib. Además, plitidepsina se está estudiando también en un estudio pivotal fase II como agente único en linfoma de células T angioinmunoblástico en recaída o refractario.
También ha finalizado un ensayo de registro fase III en mieloma múltiple en recaída o refractario con resultados positivos. Plitidepsina ha recibido designación de fármaco huérfano por la Agencia Europea de Medicamentos (EMA) y la Food and Drug Administration (FDA).
Bibliografia
i http://www.pharmamar.com/wp-content/uploads/2016/03/NdP_Resultados-positivos_ADMYRE.pdf
ii San Miguel J, et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): a randomised, open-label, phase 3 trial. Lancet Oncol (2013) 14 (11): 1055-66.
iii Richardson PG, et al. PANORAMA 2: panobinostat in combination with bortezomib and dexamethasone in patients with relapsed and bortezomib-refractory myeloma. Blood (2013) 122 (14): 2331-7.
Richardson PG, et al. Panobinostat plus bortezomib and dexamethasone in previously treated multiple myeloma: outcomes by prior treatment. Blood (2016) 127 (6): 713-21.
iv Lonial S, et al. Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. Lancet (2016) 387 (10027): 1551-60.
v Richardson PG, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med (2005) 352 (24): 2487-98.
vi Dimopoulos M, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med (2007) 357 (21): 2123-32.
vii http://www.cancer.org/cancer/multiplemyeloma/detailedguide/multiple-myeloma-what-is-it
viii http://www.myeloma.org.uk/information/what-is-myeloma/
ix http://seer.cancer.gov/statfacts/html/mulmy.html
x http://www.esmo.org/Guidelines/Haematological-Malignancies/Multiple-Myeloma
xi GLOBOCAN 2012, IARC – 6.9.2016
Fuente: PharmaMar